臨床成績
- (1) 国内臨床試験成績
- 慢性閉塞性肺疾患患者147例を対象に本剤5μgとチオトロピウム粉末吸入剤18μgとの二重盲検クロスオーバー試験を国内で実施した。その結果、本剤5μgのチオトロピウム粉末吸入剤18μgに対する非劣性が検証された(p<0.001)。18)
- 本剤(Tio R)とチオトロピウム粉末吸入剤(Tio HH)のトラフFEV1(変化量)に対する成績
- Tio R 5
- 症例数:134
平均値(SE):0.109(0.006)
95%CI:0.097-0.120 - Tio HH 18
- 症例数:134
平均値(SE):0.101(0.006)
95%CI:0.089-0.113 - Tio R 5-Tio HH 18
- 症例数:134
平均値(SE):0.008(0.009)
95%CI:-0.009-0.024
P値(非劣性):<0.001 - 注)第1期と第2期のFEV1のベースライン値と投与後の値があるものを有効性の主解析集団とした。
- チオトロピウム粉末吸入剤の国内臨床試験成績
- 慢性閉塞性肺疾患患者27例を対象とした国内第II相試験19)及び慢性閉塞性肺疾患患者362例(粉末吸入剤18μg投与177例)を対象とした国内第III相二重盲検比較試験20)、長期投与試験21)の結果、粉末吸入剤の有用性が認められた。粉末吸入剤の1日1回18μg吸入投与における臨床試験成績の概要は次のとおりであった。
- 1) 肺機能検査値に対する成績
- 粉末吸入剤は投与後速やかに肺機能検査値(FEV1)を上昇させ、その効果は投与後24時間持続した。19)また、オキシトロピウム臭化物に比し、肺機能検査値(トラフFEV1)を有意に上昇させた。20,21)
- チオトロピウム粉末吸入剤(Tio HH)のトラフFEV1に対する成績
- 第III相二重盲検比較試験(4週投与)
薬剤:Tio HH
症例数:63 - FEV1投与前値(L):0.99±0.04
トラフFEV1変化量(L):0.12±0.02
P値(分散分析):P=0.0001 - 第III相二重盲検比較試験(4週投与)
薬剤:オキシトロピウム
症例数:67 - FEV1投与前値(L):0.97±0.05
トラフFEV1変化量(L):0.02±0.02
P値(分散分析):P=0.0001 - 第III相長期投与試験(1年投与)
薬剤:Tio HH
症例数:100 - FEV1投与前値(L):0.96±0.04
トラフFEV1変化量(L):0.09±0.02
P値(分散分析):P=0.0005 - 第III相長期投与試験(1年投与)
薬剤:オキシトロピウム
症例数:46 - FEV1投与前値(L):0.94±0.05
トラフFEV1変化量(L):-0.02±0.03
P値(分散分析):P=0.0005 - 平均値±SE
- 2) 呼吸困難に対する成績
- 粉末吸入剤はオキシトロピウム臭化物に比し、呼吸困難(息切れの程度を点数化して評価)を有意に改善した。20,21)
- 3) 急性増悪に対する成績
- 粉末吸入剤投与時の急性増悪の回数及び急性増悪の日数はオキシトロピウム臭化物に比し、有意に少なかった。21)また、オキシトロピウム臭化物に比し、急性増悪が発現するまでの期間を有意に遅延させた。21)
- 4) 生活の質(QOL)に関する成績
- St.George’s Respiratory QuestionnaireによるQOLに関する調査において、粉末吸入剤はオキシトロピウム臭化物に比し、QOLを有意に改善した。21)
- (2) 海外臨床試験成績
- 慢性閉塞性肺疾患患者2,697例(本剤1日1回5μg吸入投与849例)を対象とした1年投与による二重盲検比較試験2試験22,23)及び12週投与による二重盲検比較試験2試験24,25)により、肺機能検査値を検討した。また、1年投与の2試験では呼吸困難、急性増悪及び生活の質(QOL)についても検討した。22,23,26)
- 1) 肺機能検査値に対する成績
- 本剤はプラセボ及びイプラトロピウム臭化物水和物に比し、肺機能検査値(トラフFEV1)を有意に改善した。26,27)
- 本剤(Tio R)のトラフFEV1に対する成績
- プラセボ対照二重盲検比較試験(1年投与)
薬剤:Tio R
症例数:650 - FEV1投与前値(L):1.068±0.016
トラフFEV1変化量(L):0.087±0.009
P値(分散分析):P=0.0001 - プラセボ対照二重盲検比較試験(1年投与)
薬剤:プラセボ
症例数:603 - FEV1投与前値(L):1.067±0.016
トラフFEV1変化量(L):-0.040±0.009
P値(分散分析):P=0.0001 - イプラトロピウム対照二重盲検比較試験(12週投与)
薬剤:プラセボ
症例数:171 - FEV1投与前値(L):1.188±0.032
トラフFEV1変化量(L):-0.014±0.017
P値(分散分析):P=0.0001 - イプラトロピウム対照二重盲検比較試験(12週投与)
薬剤:Tio R
症例数:175 - FEV1投与前値(L):1.068±0.030
トラフFEV1変化量(L):0.104±0.016
P値(分散分析):P=0.0001 - イプラトロピウム対照二重盲検比較試験(12週投与)
薬剤:Tio R
症例数:175 - FEV1投与前値(L):1.068±0.030
トラフFEV1変化量(L):0.104±0.016
P値(分散分析):P=0.0060 - イプラトロピウム対照二重盲検比較試験(12週投与)
薬剤:イプラトロピウム
症例数:170 - FEV1投与前値(L):1.101±0.033
トラフFEV1変化量(L):0.040±0.017
P値(分散分析):P=0.0060 - 平均値±SE
- 2) 呼吸困難に対する成績(1年投与試験)22,23,26)
- 本剤はプラセボに比し、呼吸困難(Transition Dyspnoea Indexを用いて評価)を有意に改善した。
- 3) 急性増悪に対する成績(1年投与試験)22,23,26)
- 本剤はプラセボに比し、急性増悪の回数を有意に減少し、最初の急性増悪が発現するまでの期間も有意に遅延させた。
- 4) 生活の質(QOL)に関する成績(1年投与試験)22,23,26)
- St.George’s Respiratory QuestionnaireによるQOLに関する調査において、本剤はプラセボに比し、QOLを有意に改善した。
- (1) 日本人を含む国際共同試験成績
- 高用量のICS+LABAの治療下でも症状が持続する重症持続型喘息患者912例(日本人65例)を対象とした国際共同二重盲検比較試験2試験(205.416試験及び205.417試験、本剤5μgまたはプラセボを1日1回、48週吸入投与)において、456例(日本人36例)に本剤5μgを投与した。臨床試験成績の概要は次のとおりであった。
- 1) 肺機能検査値に対する成績28,29)
- 本剤5μgはプラセボに比し、投与24週後の肺機能検査値(ピークFEV1及びトラフFEV1)を統計学的に有意に改善した。日本人集団の成績は全体集団と比較して同様の傾向がみられた。
- 本剤5μg(Tio R 5)のピークFEV1(変化量)及びトラフFEV1(変化量)に対する成績(全体集団)
- 205.416試験:ピークFEV1
薬剤:Tio R 5 - ベースライン:1.596±0.546(237)
投与24週後:2.048±0.663(217)
変化量:0.444±0.426(217)
プラセボ群との差[95%信頼区間]a)、p値a) b):0.086[0.020,0.152] p=0.0110 - 205.416試験:ピークFEV1
薬剤:プラセボ - ベースライン:1.558±0.537(222)
投与24週後:1.899±0.670(211)
変化量:0.351±0.372(211) - 205.416試験:トラフFEV1
薬剤:Tio R 5 - ベースライン:1.596±0.546(237)
投与24週後:1.793±0.599(217)
変化量:0.189±0.366(217)
プラセボ群との差[95%信頼区間]a)、p値a) b):0.088[0.027,0.149] p=0.0050 - 205.416試験:トラフFEV1
薬剤:プラセボ - ベースライン:1.558±0.537(222)
投与24週後:1.656±0.613(211)
変化量:0.107±0.333(211) - 205.417試験:ピークFEV1
薬剤:Tio R 5 - ベースライン:1.659±0.569(219)
投与24週後:2.043±0.681(205)
変化量:0.388±0.388(205)
プラセボ群との差[95%信頼区間]a)、p値a) b):0.154[0.091,0.217] p<0.0001 - 205.417試験:ピークFEV1
薬剤:プラセボ - ベースライン:1.598±0.506(234)
投与24週後:1.831±0.615(218)
変化量:0.248±0.363(218) - 205.417試験:トラフFEV1
薬剤:Tio R 5 - ベースライン:1.659±0.569(219)
投与24週後:1.802±0.624(204)
変化量:0.143±0.355(204)
プラセボ群との差[95%信頼区間]a)、p値a) b):0.111[0.053,0.169] p=0.0002 - 205.417試験:トラフFEV1
薬剤:プラセボ - ベースライン:1.598±0.506(234)
投与24週後:1.631±0.544(218)
変化量:0.048±0.308(218) - 平均値±SD(例数)
- a)投与群、実施医療機関、Visit、投与群とVisitの交互作用、ベースライン値、ベースライン値とVisitの交互作用を固定効果、被験者を変量効果とし、被験者内でspatial power共分散構造を仮定した反復測定混合モデル。
- b)投与24週後のピークFEV1におけるTio R 5群とプラセボ群、投与24週後のトラフFEV1におけるTio R 5群とプラセボ群、48週間の投与期間中の最初の重度の喘息増悪までの期間におけるTio R 5群とプラセボ群との各対比較の順に階層が設定されたステップダウン法により、検定の多重性を調整。
- 2) 喘息増悪に対する成績30)
- 205.416試験及び205.417試験の併合データにおいて、本剤5μgはプラセボに比し、重度の喘息増悪の発現リスクを統計学的に有意に減少させた。
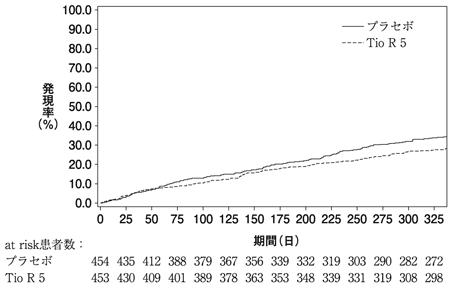
最初の重度の喘息増悪までの期間のKaplan-Meier曲線(全体集団)- 本剤5μg(Tio R 5)の喘息増悪に対する成績
- 増悪割合
- Tio R 5:26.9(122/453)
プラセボ:32.8(149/454) - 未調整ハザード比[95%信頼区間]a)未調整p値a)
- Tio R 5:0.79[0.62,1.00] p=0.0535
- 調整済みハザード比[95%信頼区間]b)調整済みp値c)
- Tio R 5:0.77[0.60,0.98] p=0.0343
- %(例数)
- a)投与群を説明変数としたCox比例ハザードモデル
- b)平均不偏推定量
- c)Cui, Hung and Wang(1999)の重み付きZ統計量に基づく方法(主要解析)。投与24週後のピークFEV1におけるTio R 5群とプラセボ群、投与24週後のトラフFEV1におけるTio R 5群とプラセボ群、48週間の投与期間中の最初の重度の喘息増悪までの期間におけるTio R 5群とプラセボ群との各対比較の順に階層が設定されたステップダウン法により、検定の多重性を調整。
- (2) 国内長期投与試験成績
- 中用量のICSの治療下でも症状が持続する喘息患者285例を対象とした52週吸入投与による国内長期投与試験において、114例に本剤1日1回5μgが投与された。その結果、本剤5μgのトラフFEV1の効果は52週間維持された。31)